Die Gesundheitsbranche durchläuft aufgrund technologischer Fortschritte eine tiefgreifende Transformation, die zu optimierten Abläufen, verbesserten Patientenversorgung und gesteigerter Kommunikationseffizienz zwischen den Akteuren der Branche führt. Von elektronischen Patientenakten (EHRs) und elektronischen Krankenakten (EMRs) über Telemedizin-Lösungen bis hin zu tragbaren Gesundheitsgeräten ebnet die digitale Technologie den Weg zu einer stärker vernetzten Gesundheitslandschaft.
Um die Sicherheit, Effizienz und Interoperabilität von Dienstleistungen und Software für Gesundheitswesen zu gewährleisten, ist die Einhaltung strenger Standards von entscheidender Bedeutung. In unseren Interviews haben wir bereits ausführlich auf HIPAA, PHIPA, DICOM, HL7 und andere bekannte Gesundheitsvorschriften eingegangen. Heute werden wir uns auf zwei weniger bekannte, aber dennoch wichtige Standards konzentrieren – ONC und FDA 21 CFR Teil 820. Da wir viel zu besprechen haben, schnallen Sie sich an, wir steigen gleich ein.
Lassen Sie uns mit ONC beginnen. Worum geht es dabei?
Das Amt des Nationalen Koordinators für Gesundheitsinformationstechnologie (ONC) ist im US-amerikanischen Gesundheitsministerium angesiedelt. Gegründet im Jahr 2004, setzt sich ONC dafür ein, den Fortschritt und die weitreichende Verbreitung von Gesundheits-IT zu fördern und den sicheren Austausch von Gesundheitsinformationen zu gewährleisten.
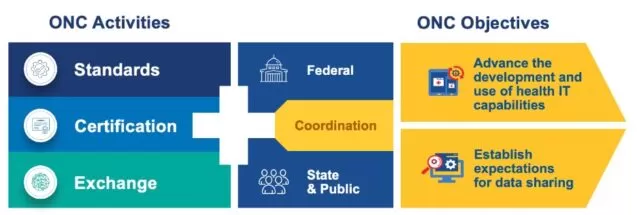
Grundsätzlich ist ONC dafür verantwortlich, Standards festzulegen, Zertifizierungen auszustellen und den Austausch von Gesundheitsinformationen zu überwachen. Die ONC-Standards gelten sowohl auf föderaler als auch auf Landesebene. Das übergreifende Ziel besteht darin, die Entwicklung zuverlässiger und gründlich getesteter Softwarelösungen im Gesundheitswesen sicherzustellen.
Zusätzlich stellt ONC vorkonfektionierte Lösungen bereit, die von privaten und staatlichen Organisationen genutzt werden können:
- Apps: Werkzeuge, die dazu dienen, offene Daten zu visualisieren und zu analysieren.
- Quick Stats: Visuelle Darstellungen, die wesentliche Gesundheits-IT-Daten und Statistiken präsentieren.
- Data Briefs: Bereitstellung von Statistiken zur Verbreitung und Nutzung von Gesundheits-IT, die aus Umfragen und administrativen Daten abgeleitet sind. Hierbei wird auch eine umfassende Analyse von Gesundheits-IT-Richtlinien und -Programmen durchgeführt.
- Datasets: Umfassen Daten aus Umfragen und Programmen, die von der Regierung unterstützt werden.
Lassen Sie uns über das ONC Health IT Certification Program sprechen. Was beinhaltet es?
Eingeführt im Jahr 2010 zielt das ONC Health IT Certification Program darauf ab, sicherzustellen, dass Gesundheits-IT-Lösungen wesentlichen Standards für Sicherheit und Interoperabilität entsprechen. Das Programm basiert auf den Grundsätzen, die von ISO und IEC festgelegt wurden.
Es sollte auch erwähnt werden, dass die Teilnahme am ONC Health IT Certification Program freiwillig ist. Wenn Sie eine Gesundheitslösung nur für den eigenen Gebrauch entwickeln, können Sie den Zertifizierungsprozess vollständig umgehen. Angesichts der Tatsache, dass jedoch die meisten Softwarelösungen von einer Vielzahl von medizinischen und nicht-medizinischen Organisationen genutzt werden, wird die Zertifizierung obligatorisch.
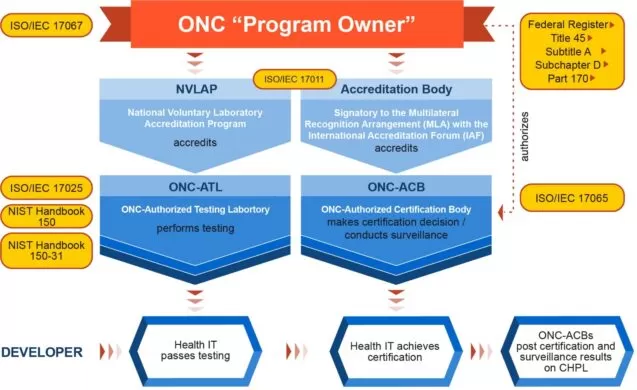
Es sei jedoch darauf hingewiesen, dass die ONC selbst keine Konformitätsbewertung durchführt oder Zertifizierungen bereitstellt. Zu diesem Zweck arbeitet ONC mit autorisierten Dritten zusammen. Diese Parteien umfassen ein Prüflabor, das für die Testaktivitäten verantwortlich ist, sowie ein Akkreditierungsorgan, das die offizielle Zertifizierung bereitstellt. Es ist klar, dass eine Lösung oder ein Softwaremodul ohne bestandene Tests nicht für den Zertifizierungsprozess in Frage kommt.
Diejenigen Gesundheits-IT-Module, die durch das Zertifizierungsprogramm getestet und zertifiziert wurden, werden in der Certified Health IT Product List (CHPL) aufgeführt. Jede auf der CHPL aufgeführte Softwarelösung erhält von der autorisierten Zertifizierungsstelle eine CHPL-Produktnummer.
Was den Zertifizierungsprozess betrifft, folgt er den nachstehenden Phasen:
Lassen Sie uns zu den ONC-Zertifizierungskriterien zurückkehren. Was umfassen sie?
Die ONC-Zertifizierungskriterien sind funktionale Anforderungen, die erfüllt sein müssen, wenn eine Gesundheits-IT-Lösung entwickelt wird. Um zusätzliche Einblicke und Klarstellungen zu den Zertifizierungskriterien zu bieten, hat ONC auch einen Certification Companion Guide erstellt.
Seit der Einführung des Zertifizierungsprogramms hat ONC drei Versionen der Zertifizierungskriterien veröffentlicht, wobei jedes Mal auf Bundesgesetzen und Regelungen aufgebaut wurde. Die neueste Ausgabe ist die 2015 Edition Cures Update, die speziell Änderungen anspricht, die durch den 21st Century Cures Act erforderlich sind.
Es gibt sechzig Zertifizierungskriterien, die in 8 Kategorien organisiert sind, wie folgt:
Quelle: HealthIT.gov
ONC hat die Anforderungen an die Bedingungen und die Aufrechterhaltung der Zertifizierung festgelegt und beschreibt dabei speziell, wie das erforderliche Qualifikationsniveau sowohl für Entwickler als auch für das System selbst aufrechterhalten werden kann.
Haben Sie irgendwelche Empfehlungen für diejenigen, die Lösungen für das Gesundheitswesen entwickeln?
Meiner Erfahrung nach kann der Umgang mit den ONC-Anforderungen knifflig sein. Im Folgenden habe ich einige praktische Tipps zusammengefasst, die funktionieren:
- Wenn Sie eine Softwarelösung für das Gesundheitswesen für den US-amerikanischen Markt entwickeln, ist es empfehlenswert, einen medizinischen oder gesundheitspolitischen Berater an Bord zu haben. Wenn Sie diesen Experten an Ihrer Seite haben, können Sie die notwendige Beratung erhalten, ohne den Kunden zu belästigen.
- Die Einhaltung von Vorschriften, insbesondere in der Gesundheitsbranche, ist sehr komplex, teuer und zeitaufwändig. Versuchen Sie, wann immer möglich, einen ONC-zertifizierten Berater zu engagieren, der Sie zu den Anforderungen der Norm berät, bei der vorläufigen Bewertung hilft und während des gesamten ONC-Zertifizierungsprozesses Unterstützung bietet.
- Obwohl einige Teile oder Module des in der Entwicklung befindlichen Systems möglicherweise noch nicht nach dem ONC-Standard zertifiziert sind, können sie innerhalb der Organisation verwendet werden. Eine vollständige ONC-Zertifizierung ist nur dann obligatorisch, wenn das System für den Einsatz auf Bundes- oder nationaler Ebene vorgesehen ist.
Tatsächlich spielt die ONC eine wichtige Rolle bei der Förderung der Interoperabilität und der Weiterentwicklung einer patientenzentrierten Gesundheitsversorgung. Nun, wie sieht es mit FDA 21 CFR Teil 820 aus? Wofür steht dieser Standard?
FDA 21 CFR Teil 820 ist eine Reihe von Richtlinien, die von der Food and Drug Administration (FDA) erstellt wurden, um Hersteller bei der Herstellung von Medizinprodukten in die richtige Richtung zu lenken.
Diese Qualitätsmanagementsystem-Verordnung (QMS) ist wie ein Handbuch, das die Gestaltung, Überwachung und Instandhaltung von Produktionsstätten und -prozessen leitet. Ihr Hauptziel ist es sicherzustellen, dass das Endprodukt – Medizinprodukte – sicher und wirksam ist.
Unten sehen Sie die Stellung von Teil 820 in der Gesamthierarchie der FDA-Vorschriften:
Lassen Sie uns einige der Schlüsselbegriffe in FDA 21 CFR Teil 820 näher betrachten:
- Qualitätssystem (Quality System): Dies bezieht sich auf die Gesamtausrichtung – Struktur, Verantwortlichkeiten, Verfahren, Prozesse und Ressourcen – für ein effektives Qualitätsmanagement.
- Hersteller (Manufacturer): Ein Hersteller ist jede Person oder Einrichtung, die an der Gestaltung, Herstellung, Montage oder Verarbeitung eines fertigen Produkts beteiligt ist. Wenn ein Hersteller einige, aber nicht alle in dieser Verordnung genannten Aktivitäten durchführt, muss er nur die anwendbaren Anforderungen für diese spezifischen Vorgänge erfüllen. Der Begriff erstreckt sich auch auf Einrichtungen, die an Installation, Neu-Kennzeichnung, Neu-Herstellung, Neu-Verpackung, Spezifikationsentwicklung und erstmaliger Verteilung beteiligt sind.
Es ist wichtig zu beachten, dass die FDA jemanden auch dann als „Hersteller“ betrachtet, wenn alle Herstellungsaktivitäten ausgelagert werden. Diese Verordnung gilt jedoch nicht für die Hersteller, die nur Komponenten oder Teile fertiger Geräte herstellen. Dennoch werden solche Komponentenhersteller ermutigt, relevante Teile dieser Verordnung als Leitfaden zu befolgen.
Die FDA überwacht die Einhaltung durch zwei Arten von Inspektionen: geplante, die im Voraus angekündigt werden, und unangekündigte Inspektionen. Sie verwenden die Quality System Inspection Technique (QSIT), um zu überprüfen, ob interne Qualitätsprozesse mit den behördlichen Anforderungen übereinstimmen.
Nichtkonformität mit einer relevanten Bestimmung führt dazu, dass ein Gerät als verunreinigt gilt, und sowohl das Gerät als auch die für die Nichtkonformität verantwortliche Partei unterliegen behördlichen Maßnahmen. Verstöße können zur Ausstellung von Form 483-Beobachtungen und Warnschreiben führen.
Obwohl die FDA keine vorgeschriebene Vorabprüfung verlangt, ist die rechtliche Einhaltung der anwendbaren Abschnitte der Quality System Regulation (QSR) vor Markteinführung eines Geräts verpflichtend.
FDA 21 CFR Teil 820 scheint ähnlich wie ISO 13485 zu sein. Was sind die Hauptunterschiede?
Beide Standards behandeln Qualitätsmanagementsysteme für Medizinprodukte, haben jedoch unterschiedliche Anwendungsbereiche, Zwecke und regulatorische Kontexte. Die Hauptunterschiede sind:
- FDA 21 CFR Teil 820 ist verpflichtend, während ISO 13485 optional ist;
- FDA 21 CFR Teil 820 gilt ausschließlich für die Vereinigten Staaten;
- ISO 13485 folgt einer modernisierten Struktur, während FDA 21 CFR Teil 820 dasselbe Format seit 1997 beibehalten hat;
- FDA 21 CFR Teil 820 wurde ausschließlich von der FDA entwickelt, während ISO 13485 in Zusammenarbeit erstellt wurde;
- Es gibt einen geplanten Versuch der FDA, die Quality System Regulation (QSR) mit ISO 13485 in Einklang zu bringen.
Was bedeutet diese Norm für Softwareentwicklungsunternehmen?
Ein Softwareentwicklungsunternehmen kann Hersteller unterstützen, indem es elektronische QMS-Lösungen (eQMS) für Medizinprodukteunternehmen entwickelt, um die Anforderungen zu erfüllen. Dieses eQMS kann die folgenden Komponenten umfassen:
- Konstruktionskontrollen, um sicherzustellen, dass Medizinprodukte entsprechend ihren Anforderungen konstruiert werden.
- Modul für die Dokumentenkontrolle, um die Genehmigung und Verteilung von Schlüsseldokumenten zu ermöglichen und sicherzustellen, dass diese sowohl sicher als auch bei Bedarf zugänglich sind.
- Lieferantenmanagement zur Bewertung von Lieferanten und Auftragnehmern sowie zur Verwaltung von Aufzeichnungen und Einkaufsdaten.
- Aufzeichnungs- und Beschwerdemanagement, um sicherzustellen, dass die Aufzeichnungen für FDA-Inspektionen verfügbar sind.
- Implementierung einer lückenlosen Rückverfolgbarkeit, damit das Medizinprodukt bis zu seiner Quelle zurückverfolgt werden kann.
Fazit
Es versteht sich von selbst, dass der Aufbau einer Lösung für das Gesundheitswesen keine leichte Aufgabe ist, und wir bei Elinext verstehen diese Realität sehr gut. Technologische Entscheidungen müssen stets mit strengen Vorschriften in Einklang gebracht werden, um Effizienz, Interoperabilität, Datensicherheit und den Schutz der Privatsphäre der Patienten zu gewährleisten. Unser Fachwissen im Bereich des Gesundheitswesens basiert auf mehr als 20 Jahren Erfahrung in der Entwicklung kundenspezifischer medizinischer Lösungen, darunter EHRs und EMRs, mobile Gesundheitsanwendungen, pharmazeutische Lösungen, medizinische Abrechnungsplattformen und vieles mehr. Zur Veranschaulichung des Sachverhalts sehen Sie sich eine Fallstudie über eine groß angelegte, 21 CFR Part 11-konforme SaaS-Plattform an. Diese Plattform wurde speziell für die Verwaltung und Zusammenarbeit bei klinischen Studien entwickelt und verdeutlicht unser Engagement für die Einhaltung der hohen regulatorischen Standards in der Gesundheitsbranche.
Wenn Sie die Hilfe von Experten in der Entwicklung von Gesundheitssoftware brauchen, kontaktieren Sie uns.